Echographie de contraste
Il existe des limitations techniques à l’usage des ultrasons en imagerie médicale dans certains territoires du corps humain. Ainsi les structures du corps contenues dans une enveloppe réfléchissant les ultrasons plutôt que de les laisser passer sont difficilement examinées en échographie. Par exemple le cerveau constitué de graisse et d’eau serait très accessible aux techniques d’imageries ultrasonographiques s’il n’était pas enveloppé de la boite osseuse du crâne.
De même les flux circulants de façon très lente sont difficilement détectables. C’est le cas de la microcirculation au sein des organes.Pour palier ces limites physiques, il a été proposé de recourir à une amplification du signal en provenance des vaisseaux des tissus en y faisant circuler un produit qui augmente le contraste ultrasonographique.
Principe de l’imagerie d’harmonique
Lors de la propagation de l’onde ultrasonore dans les tissus du corps humain qui ne sont pas tous homogènes, l’onde se déforme. Les pics positifs de pression se propagent à plus grande vitesse que les pics négatifs .En effet, sous l’effet de la pression acoustique, les tissus présentent des variations locales transitoires de densité, donc de célérité des ultrasons.
Ce comportement des tissus vis-à-vis de la propagation du signal fondamental est dit « non linéaire ». Son spectre s’enrichit alors en fréquences multiples et sous-multiples de la fréquence fondamentale : « les « harmoniques ». Au moyen d’un filtrage “passe-haut” on ne retient, en réception, que les signaux centrés sur la fréquence harmonique, donc proches du double de la fréquence d’émission (dite « fondamentale »). Le contraste « utile » de l’image s’en trouve renforcé, car le « bruit » ainsi supprimé concerne surtout les intensités modestes ou faibles. L’apport de l’imagerie harmonique à la qualité de l’image échographique est tel que ce mode est désormais le plus souvent mis en œuvre par défaut.
Cependant, l’imagerie harmonique n’est pas la panacée universelle. Elle fait perdre un peu de pénétration tissulaire et peut donc être en échec aux grandes profondeurs d’exploration, mais la séparation harmonique / fondamentale ne peut être parfaite, en raison du chevauchement partiel des spectres de fréquence. Des modalités complémentaires d’émission ultrasonore et de traitement des signaux ont donc été développées.
La principale modalité répondant à cette question est l’inversion de phase de l’impulsion (pulse inversion). L’émission ultrasonore est réalisée par paires d’impulsions, la seconde étant de forme identique à la première mais en opposition de phase. Si la réponse tissulaire aux variations de pression acoustique est linéaire, les deux échos produits par la réflexion de la première et de la seconde impulsion acoustique sont parfaitement symétriques, et leur soustraction algébrique produit un résultat nul ou presque. Si, par contre, la réponse tissulaire est non linéaire (donc s’accompagnant d’une modification du spectre de fréquences), la distorsion de l’impulsion n’est pas symétrique en compression et décompression, et les échos sont donc de forme différente, de sorte que leur soustraction algébrique donne un résultat différent de zéro. Ce mode d’imagerie par double impulsion en inversion de phase permet de distinguer parfaitement les milieux de comportement non linéaire. Il est donc parfaitement adapté à l’utilisation des produits de contraste ultrasonore
L’histoire des produits de contraste en ultrasonographie est plus ancienne que celle de l’imagerie harmonique, mais l’histoire de l’imagerie harmonique est indissociable de celle des produits de contraste, puisque l’imagerie harmonique a été imaginée précisément pour l’exploitation des produits de contraste. Il s’est avéré ensuite que l’imagerie harmonique était exploitable aussi sans utilisation de produits de contraste. nombreux laboratoires pharmaceutiques ont ensuite entrepris de développer des produits injectables susceptibles de renforcer le signal ultrasonore.
Le temps de persistance des microbulles dans la circulation sanguine est un élément déterminant de leur efficacité. Cette durée d’utilisation dépend de la densité et du coefficient de diffusion du gaz utilisé, du rayon des microbulles, et de la concentration du gaz dissous à saturation dans le plasma. Sous l’effet des variations de pression acoustique dans le faisceau ultrasonore, les microbulles présentent des déformations (alternances compression / décompression) dépendant de la puissance acoustique. A faible puissance acoustique, les microbulles présentent une dilatation lorsque la pression diminue, et une contraction lorsqu’elle augmente. Leur effet sur l’imagerie est essentiellement lié à leur fort pouvoir diffusant. A puissance acoustique moyenne, les déformations étant asymétriques (comportement non linéaire), ces oscillations entraînent l’apparition de fréquences harmoniques. L’imagerie harmonique permet donc d’en tirer le meilleur parti, en visualisant spécifiquement le sang contenant le produit de contraste et en éliminant les autres échos. A forte puissance acoustique (indice mécanique proche de 1 ou supérieur), l’insonation provoque l’éclatement des microbulles, générant un signal bref et de très forte intensité. C’est l’imagerie « destructive », dont l’usage doit rester prudent en raison des phénomènes mécaniques et thermiques locaux qu’elle entraîne. Cet éclatement provoque, après une brève phase d’exacerbation du contraste, sa disparition, suivie de sa réapparition en fonction de la perfusion tissulaire. C’est sur ce principe qu’est fondée l’utilisation de « flashs » pour détruire le contraste puis enregistrer sa réapparition pour évaluer la perfusion tissulaire
La non-linéarité de la réponse des microbulles des produits de contraste est beaucoup plus marquée que celle des tissus, particulièrement à puissance acoustique modérée (cette différence s’estompe aux fortes puissances acoustiques). Il est donc possible de distinguer très clairement le sang circulant dans lequel a été injecté un produit de contraste, par l’imagerie harmonique et les techniques dérivées.
Quelles sont les indications de l’échographie de contraste
Dans le domaine vasculaire, les produits de contraste peuvent être utilisés pour le Doppler transcrânien lorsque la fenêtre acoustique temporale est absente ou insuffisante (et à la condition que le tableau clinique justifie la poursuite des investigations par ultrasons, donc lorsque l’angioscanner et/ou l’angioRM sont contre-indiqués ou non concluants). Le suivi des anévrismes, sur la partie tronculaire des artères cérébrales, peut en bénéficier.
Egalement, les produits de contraste ultrasonore sont très utiles pour évaluer la perfusion tissulaire et analyser la vascularisation des lésions tumorales. D’une part, le gain en sensibilité offert par le produit de contraste permet la visualisation de l’arborisation vasculaire, montrant les petits vaisseaux et leur organisation. D’autre part, il est possible d’enregistrer, dans des régions d’intérêt délimitées par l’utilisateur, des courbes d’intensité du signal après émission d’une séquence « flash », faite d’impulsions de forte intensité détruisant les microbulles. La réapparition du contraste dessine une courbe de perfusion tissulaire.
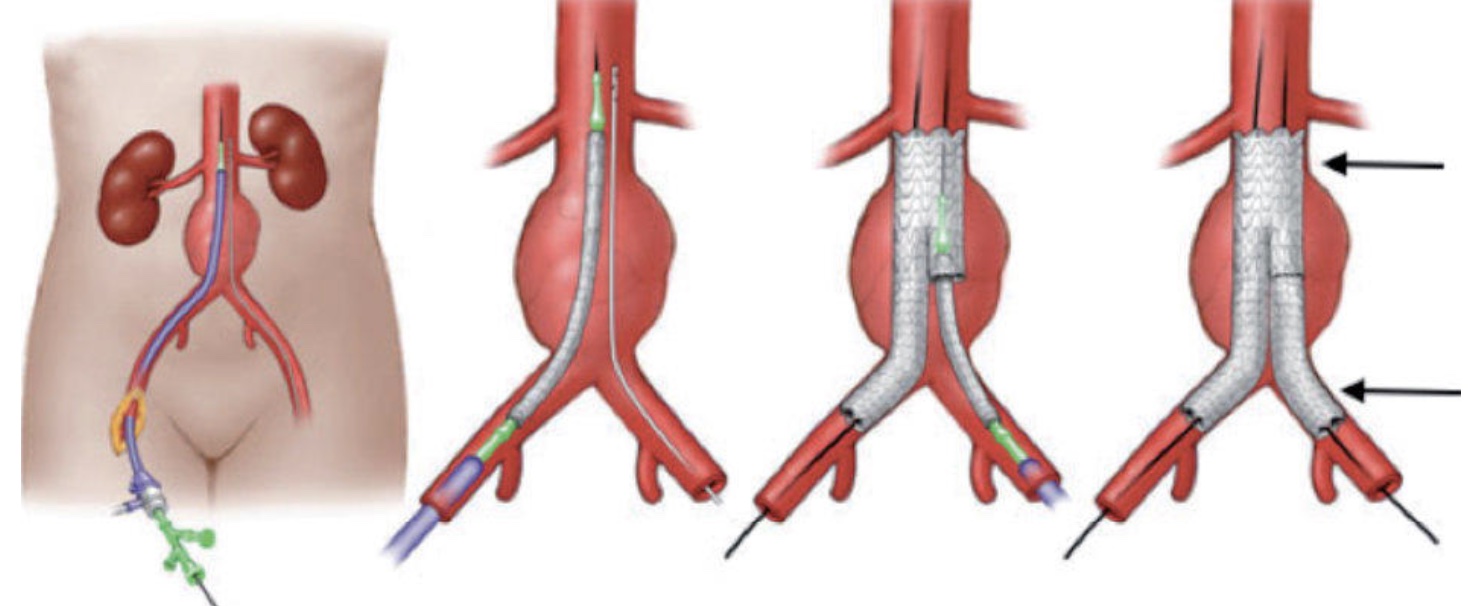
Une indication majeure des produits de contraste ultrasonore est la détection de fuite sur les endoprothèses mises en place pour le traitement d’un anévrisme aortique. Ceci permet d’éviter, chez des patients souvent âgés et dont la fonction rénale est « limite », des expositions itératives aux rayons X et à un agent de contraste iodé toxique pour les reins.
En pratique
Pour cette échographie, une perfusion vous sera posée au moment de l’examen par une infirmière. Le produit de contraste sera injecté par cette perfusion. L’examen, totalement indolore, dure un peu plus longtemps qu’une échographie habituelle. Il faut compter une heure environ.
Echographie 4 D
Actuellement, la plupart des échographes fournissent une image bidimensionnelle qui correspond au plan de coupe que le médecin réalise en manipulant la sonde d’échographie. Mais les structures étudiées possèdent trois dimensions. Le médecin doit alors « reconstruire mentalement » les caractéristiques du volume en coordonnant les images échographiques avec la position de la sonde. L’intérêt de l’échographie 3D est de réaliser cette intégration des images et des positions de manière automatique. Aujourd’hui les moyens techniques existent pour l’acquisition et l’exploitation des données échographiques tridimensionnelles. Pourtant, force est de constater que l’échographie 3D reste aujourd’hui surtout expérimentale, bien que la plupart des constructeurs proposent des modèles intégrant les traitements tridimensionnels car la puissance de calcul des ordinateurs permet une utilisation en temps réel (4D). On peut aujourd’hui manipuler des volumes de données de manière interactive.
Le problème qui se pose actuellement n’est donc plus de recueillir les données mais de savoir comment les exploiter. Les images tridimensionnelles spectaculaires montrent qu’il y a un réel potentiel dans cette nouvelle technique. L’échographie 3D/4D ne doit pas donc plus être considérée comme une simple amélioration de l’échographie 2D mais comme une autre modalité d’imagerie avec un contexte et des objectifs différe
- la mesure de volumes
- l’aide au geste chirurgical (biopsie, localisation per-opératoire, etc.)
- l’échange d’informations
Principe
L’approche de la problématique “échographie 3D” est facilitée par son analogie au monde visuel. Dans ce dernier, l’appréhension de la profondeur, ou troisième dimension, est inconsciente, innée et indispensable. Elle est caractérisée par une phase d’acquisition, chez les mammifères spécifiquement binoculaires, et par une phase représentative biplan au niveau du cortex cérébral postérieur. La question du 3D comme nous la percevons classiquement converge quasi exclusivement vers la recherche d’une représentation biplan d’un volume tridimensionnel qui s’appuie sur la multiplication d’acquisitions sous des angles différents, et cela pour une reconstruction du volume initial.
Échographie 3D reconstruction
Cette approche appelée “écho 3D reconstruction” s’est développée depuis une quinzaine d’années. Son principe est fondé sur une acquisition automatisée et sérielle d’images biplan avec intégration du positionnement de chaque plan dans l’espace analysé .Toutes les coupes implémentent une matrice numérique volumique au sein d’un système informatique capable soit d’une représentation 3D de la matrice, soit d’un redécoupage du volume selon n’importe quel plan souhaité ; cette technique n’a jamais pu passer le cap de la routine clinique en raison d’un appareillage non négligeable et d’une mise en œuvre complexe.
Échographie 3D temps réel : 4D
L’échographie 3D temps réel révolutionne l’approche 3D reconstruction en s’affranchissant des limites de l’acquisition d’images sérielles 2D. En effet, avec le développement des sondes matricielles caractérisées par une réelle surface active dotée de 64 x 64 éléments, l’acquisition devient volumique, sous la forme d’une pyramide Cette dernière possède une angulation de 60° sur 30° pour un enregistrement temps réel continu du volume cardiaque partiel ou de 90° sur 85° pour la totalité du volume cardiaque sur 4 à 8 cycles en fonction de la résolution choisie. L’information enregistrée instantanément constitue autant de matrices numériques que de phases du cycle cardiaque échantillonnées (15-20 Hz). Dans un second temps, le volume acquis est visualisé en 3D à l’écran pour une découpe illimitée avec quantification de façon similaire à l’approche reconstruction.
Quelles sont les indications d’une échographie 3D/4D
L’échographie 3D est actuellement essentiellement proposé dans le cadre des explorations obstétricales. En médecine vasculaire, elle n’est actuellement pas utilisée en routine.
Fusion d’images
Chaque technique d’imagerie a ses propres spécificités, ses forces et ses faiblesses.
Pour améliorer l’interprétation des données acquises pendant un examen pour aboutir à une meilleur connaissance d’une anomalie présente dans l’organisme, la tendance est de multiplier les imageries (Échographie, Scanner, IRM, Pet-scan, scintigraphie, etc…). Jusqu’à présent c’est le cerveau humain qui « ingurgite » les données issues des différentes modalités et qui restitue un « modèle » de l’anomalie qui permet de lui donner un nom, et de guider son traitement.
Mais toutes les imageries sont polluées par des signaux parasites qui altèrent la qualité du model final qui ne peut pas être retranscrit. Chacun en fusionnant dans sa tête les données issues des différentes modalités d’imagerie, établi son propre modèle. L’intelligence Artificielle permet aujourd’hui d’automatiser cette construction de modèle à partir des données d’imageries différentes et après un apprentissage silencieux et constant, repère plus vite et bien mieux les vraies anomalies dans les données que l’œil et le cerveau humain les plus exercés ne saurait le faire.
Plutôt que de les opposer par leurs différences, la complémentarité de ces différentes modalités d’imageries, permet au final d’améliorer la pertinence du diagnostic avec un modèle d’anomalie en volume chaque jour au plus près de la réalité, et de réaliser par exemple grâce à la fusion des images entre un échographe et un scanner ou une IRM, de réaliser sous échographie des biopsie ou des gestes thérapeutiques avec la même précision que sous scanner mais sans exposer le patient et l’équipe médicale aux rayons X, ou selon les données d’un IRM alors qu’un geste thérapeutique n’est envisageable dans cet environnement électromagnétique.
Partager
Endoprothèse aortique : traitement d’un anévrisme de l’Aorte
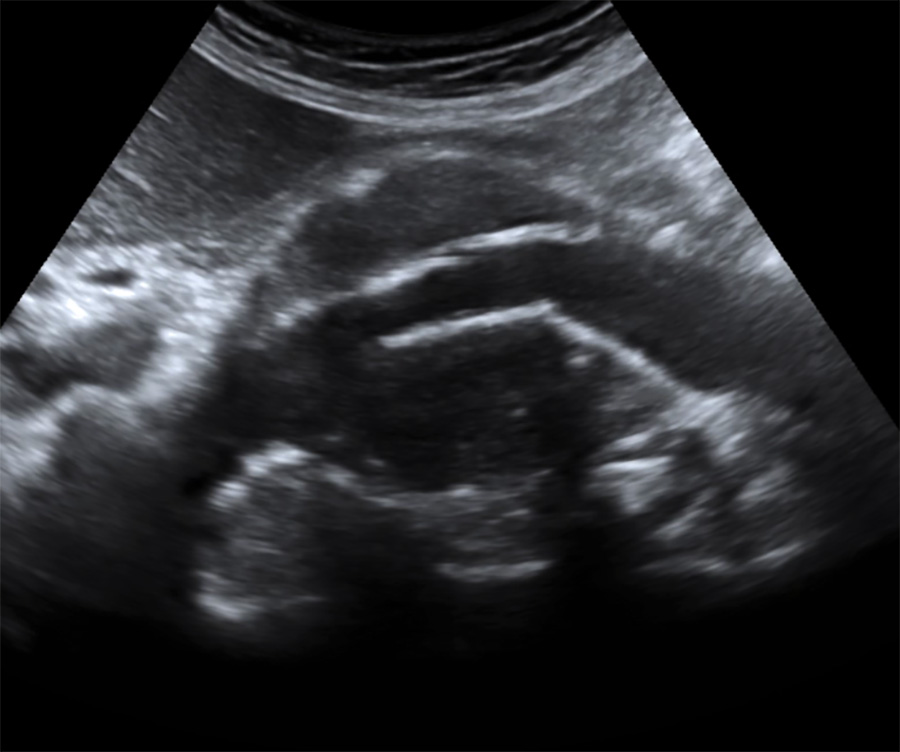
Aspect échographique en coupe longitudinale
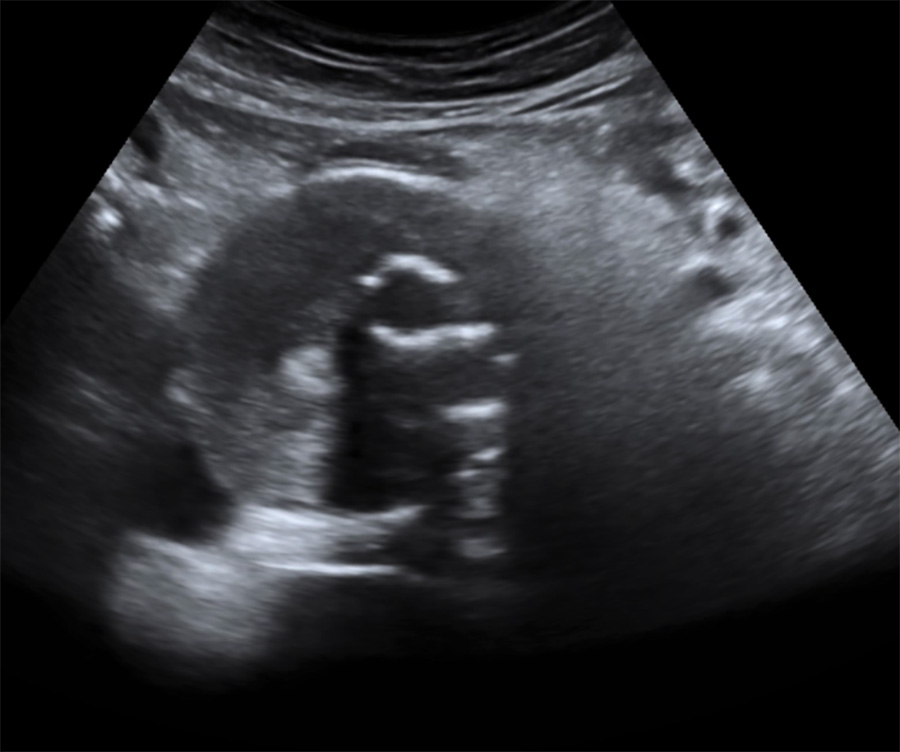
Aspect échographique en coupe axiale
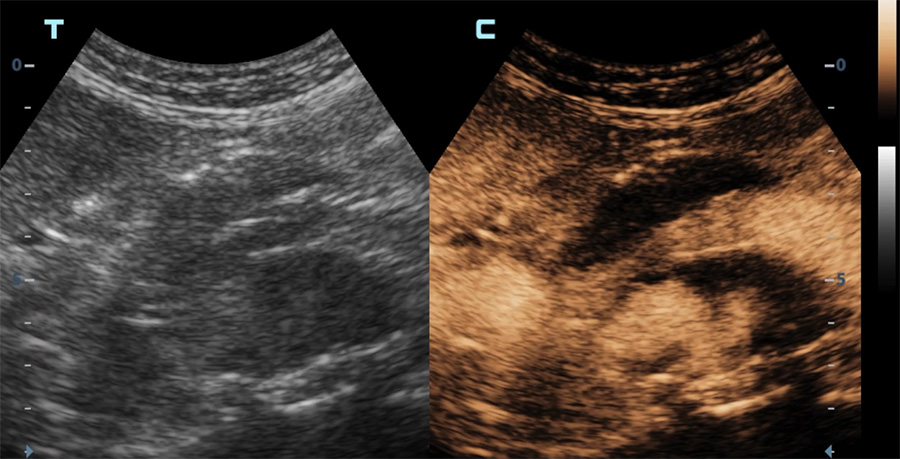
Echographie en mode contraste d’une endoprothèse aortique
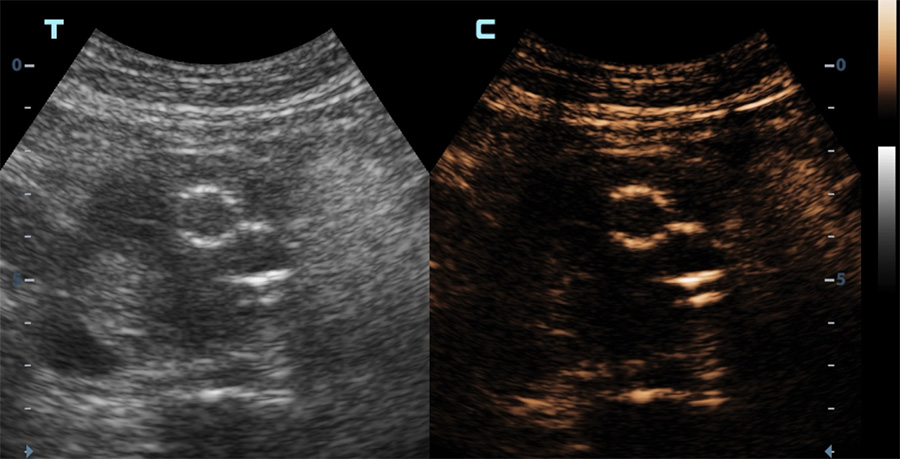
Apparition du produit de contraste dans la lumière des vaisseaux
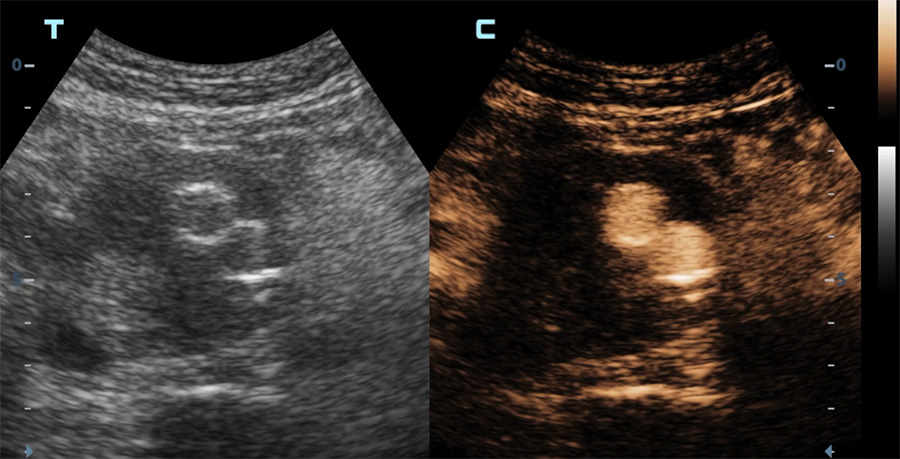
Diffusion du produit de contraste dans le sac anévrismal (vue axiale) en dehors de l’endoprothèse (endofuite)
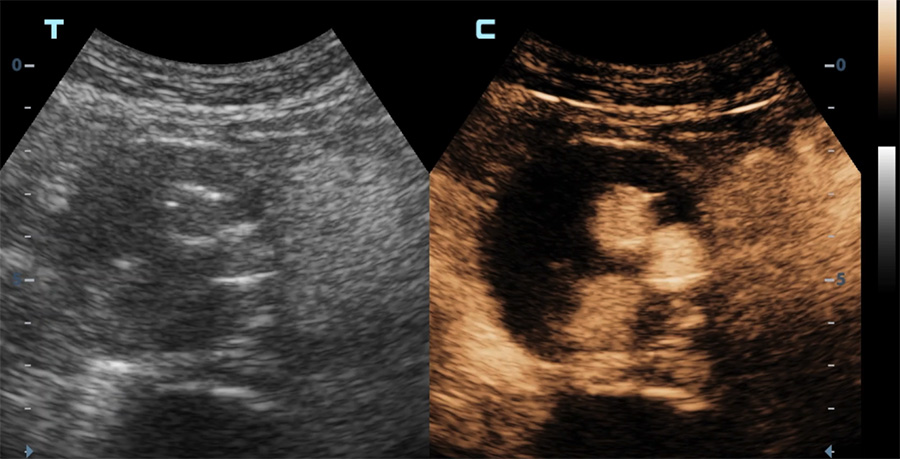
Diffusion du produit de contraste dans le sac anévrismal (vue longitudinale) en dehors de l’endoprothèse (endofuite)